En esta serie sobre los Premios Nobel recorremos estos galardones, en sus categorías de Física y Química, desde sus orígenes en 1901 en adelante. Aprovechamos así para matar dos pájaros de un tiro: hablar sobre el asunto científico de que se trate con cierta profundidad, y conocer el contexto histórico y los acontecimientos que llevaron al descubrimiento en cuestión. En el último artículo de la serie hablamos en dos partes sobre el Nobel de Física de 1918, otorgado al alemán Max Planck por su famosa hipótesis. Hoy lo haremos, por tanto, del Nobel de Química del mismo año, entregado a otro alemán, Fritz Haber, en palabras de la Real Academia Sueca de las Ciencias,
Por la síntesis del amoníaco a partir de sus elementos.
Por si no lo recuerdas, hace mucho tiempo que no hablamos de Química en esta serie: no hubo Nobel de esta categoría en 1916 ni en 1917. De hecho en 1918 se dejó vacante el premio una vez más; como sabes si sigues esta serie, la Academia a veces hace eso temporalmente, en espera de si el año siguiente puede otorgar el Nobel del año anterior. Eso pasó en este caso, y en 1919 la Academia entregó el Nobel de 1918 a Fritz Haber.

Fritz Haber (1868-1934) [dominio público].
Se trata de uno de esos premios aparentemente anodinos, y no es ningún logro teórico revolucionario (Haber no era ese tipo de químico). Eso sí, su importancia es absolutamente crucial para nuestra vida, como espero demostrar a lo largo del artículo, y además la historia de Haber me parece interesante, trágica e irónica a la vez.
¿Preparado? Como siempre, debemos retroceder en el tiempo para comprender la relevancia del logro de Fritz Haber, aunque esta vez no demasiado – tan sólo unos cien años, cuando nos empezamos a dar cuenta de que teníamos un enorme problema como especie.
Ese problema era en esencia la superpoblación, pero su consecuencia inmediata, cada vez más evidente a lo largo del siglo XIX, era la incapacidad para producir suficientes alimentos debido a la escasez de fertilizantes. Esto puede parecer una idiotez, pero no lo es.
Antes, cuando la población era más escasa y el consumo de alimentos agrícolas más lento, no había tanto problema. Se cultivaba el suelo durante un tiempo, éste se iba agotando poco a poco, luego se dejaba de cultivar durante unos cuantos ciclos vegetativos y cuando se volvía a cultivar, se había recuperado la fertilidad del suelo. También se empleaban fertilizantes naturales: abono procedente de excrementos o materia orgánica podrida, por ejemplo.
El problema es que esto funciona bien mientras que no hay un crecimiento de la población demasiado grande: la curva de población en el XVIII y sobre todo en el XIX hizo de esto un problema acuciante. Los países europeos y los Estados Unidos, los lugares donde la población crecía más rápidamente, buscaron fuentes de fertilizantes por todas partes, sobre todo los nitrogenados, que contienen nitratos de elementos metálicos.
A mediados del siglo XIX, por ejemplo, había una industria gigantesca relacionada con los fertilizantes en varios países sudamericanos. Por un lado se descubrió que el nitrato de Chile –que es una mezcla de nitrato de sodio y nitrato de potasio, NaNO3 y KNO3– era un fertilizante excelente. Había grandes depósitos de este mineral en Chile y Bolivia, y las minas de salitre (otro nombre para él) crecieron más y más a lo largo del XIX.

Barcos en las islas Chincha en un grabado de 1863 [Manuel González / CC Attribution-Sharealike 3.0 License].
La otra fuente era el guano de aves acuáticas en muchas islas de la costa del Pacífico sudamericano, por ejemplo frente a Perú y Chile. Las Islas Chincha, frente a Perú, se convirtieron en algo así como la “California del guano”. Lo mismo que la fiebre del oro hizo de California una especie de Meca en el XIX, las Chincha (unas islas minúsculas) tenían un tráfico marítimo mayor que casi cualquier puerto europeo, y los barcos volvían a casa cargados de guano para alimentar los cultivos.
¿Por qué guano? Porque contiene entre un 8 y un 16% de nitrógeno en forma de nitratos, una vez más. Y tal vez te estés preguntando, ¿por qué los nitratos eran tan importantes como fertilizante?
No voy a aburrirte aquí con una descripción del ciclo del nitrógeno (puedes leer sobre ello aquí si quieres profundizar), pero sí quiero dar una brevísima descripción de por qué el nitrógeno es importante y, sobre todo, de por qué hay “nitrógeno y nitrógeno”, y no todas las fuentes de nitrógeno son iguales.
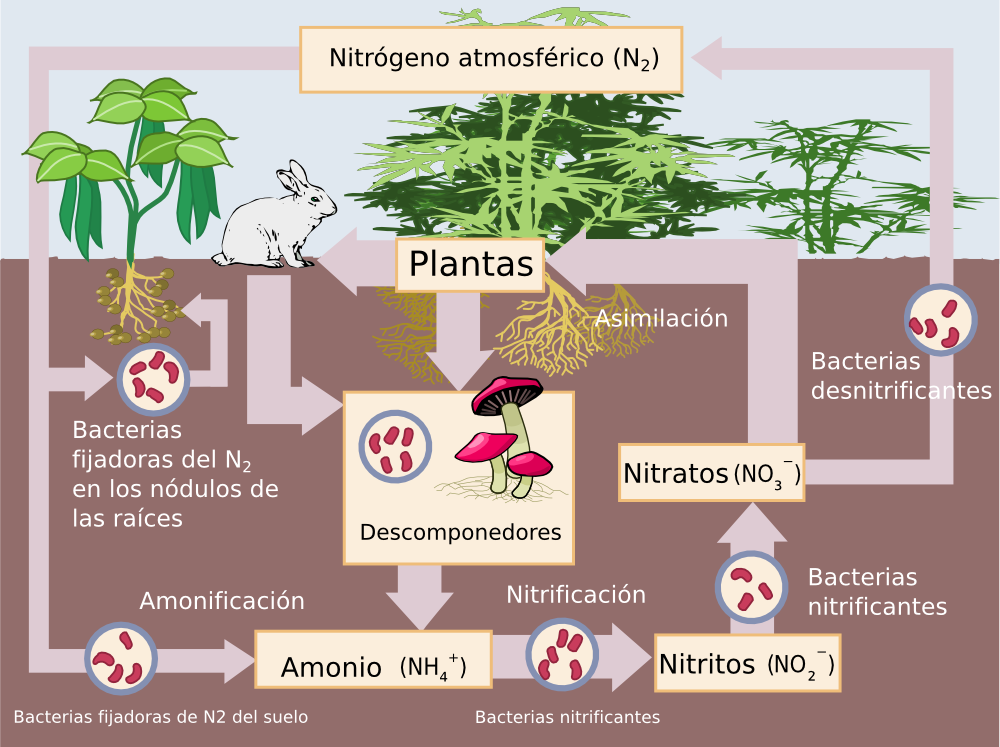
Ciclo del nitrógeno [dominio público].
Respecto a la importancia biológica del nitrógeno, es enorme: no es un elemento tan abundante en las moléculas orgánicas como el carbono, el hidrógeno o el oxígeno, pero sí fundamental. Por poner un ejemplo, todas las proteínas contienen nitrógeno. No hay ser vivo que no requiera cantidades considerables de este elemento para sobrevivir. Y el problema es que la forma en que se presenta ese nitrógeno importa, y mucho.
Si no fuera así y diera igual qué forma de nitrógeno obtener, ¿por qué razón iban a ser tan valiosos el nitrato de Chile o el guano de las Chincha? Al fin y al cabo, ¡hay nitrógeno por todas partes! El aire que nos rodea es nitrógeno en un 78%, de modo que obtener este elemento es tan fácil como respirar.
El problema es que hay poquísimos seres vivos capaces de hacer absolutamente nada con ese nitrógeno atmosférico. Se trata, como seguro que sabes, de N2, es decir, una molécula compuesta por dos átomos de nitrógeno enlazados. El enlace es un enlace covalente, en el que cada átomo de nitrógeno comparte electrones con el otro para ser estable completando una capa electrónica.
Seguro que conoces otros gases diatómicos, como el H2 o el O2. La diferencia es la siguiente: el H2 está formado por dos átomos de hidrógeno, y cada uno comparte un electrón con el otro, ya que el hidrógeno necesita un electrón más para alcanzar la estabilidad electrónica. Es lo que se llama un enlace simple. El O2, por el contrario, contiene un enlace doble, ya que cada átomo necesita dos electrones “extra” para ser estable, de modo que comparten dos. Por eso es más difícil separar los átomos de oxígeno en el O2 que los de hidrógeno en el H2.
Pero el nitrógeno necesita tres electrones más para ser estable; esto significa que los dos átomos de nitrógeno que forman el N2 están “atados” el uno al otro mediante un enlace triple, que es muy difícil de romper. Hay bacterias en el suelo, y en simbiosis con algunas plantas en la raíz, que sí pueden hacerlo. Tú y yo, estimado lector, no podemos.
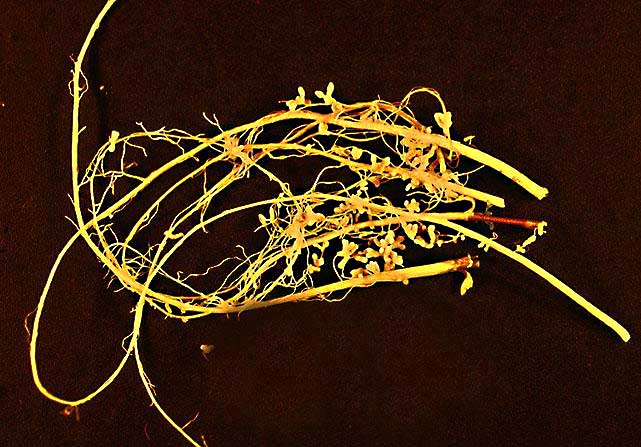
Bacterias fijadoras de nitrógeno en los nódulos de la raíz de la soja [dominio público].
Estas bacterias fijan el nitrógeno atmosférico en formas biológicamente más asequibles, y hay un ciclo bastante complejo en el que toman parte nitritos (NO2-), nitratos (NO3-) y amonio (NH4+) entre otros. Lo importante es que en todos esos casos el nitrógeno ya no está unido mediante un enlace triple a otro nitrógeno, con lo que es más fácil de asimilar.
Y el problema está en que los procesos de fijación son lentos cuando la población crece muy rápido: hace falta cada vez más cantidad de cosechas, no es posible dejar los campos en barbecho con plantas asociadas a bacterias que vayan nitrificando el suelo y, básicamente, el proceso es insostenible sin fuentes adicionales de nitrógeno asimilable biológicamente. De ahí la “fiebre del guano” del siglo XIX, que movió enormes cantidades de dinero y llevó incluso a guerras: en 1879 estalló una entre Bolivia, Chile y Perú por el control del desierto de Atacama y sus minas de salitre.
El problema no sólo era un cuestión de dinero. La dependencia del guano o el nitrato de Chile para sostener la agricultura era un peligro estratégico descomunal para muchos países. Alemania, por ejemplo, no tenía un Imperio de ultramar como el británico, de modo que dependía absolutamente del comercio global para obtener nitratos. Y si había una guerra que cortase el suministro, ¿qué pasaría con la agricultura alemana? Lo mismo para muchísimos otros países, por supuesto.
Lo que hacía aún más dolorosa esta dependencia del exterior era el hecho de que estuviésemos rodeados de nitrógeno por todas partes. ¡Si sólo fuera posible utilizar como fertilizante ese N2 atmosférico, gratuito y ubicuo! Pero, por más abundante que fuese el nitrógeno, convertirlo en una forma biológicamente accesible resultó ser algo dificilísimo en la práctica. La segunda mitad del siglo XIX y el cambio de siglo al XX fueron una lucha por conseguir un proceso industrial que liberase a la agricultura de los oligopolios del guano y el nitrato de Chile.
Como digo, hubo que esperar bastante. Los primeros en conseguir un proceso práctico para fijar el nitrógeno atmosférico fueron dos alemanes: Adolph Frank y Nikodem Caro. El método Frank-Caro, patentado en 1895, consiguió por fin lo que antes parecía imposible.

Adolph Frank (1834-1916) [dominio público].
El método Frank-Caro realizaba la siguiente reacción química para fijar el nitrógeno atmosférico:
CaC2 + N2 → CaCN2 + C
Dicho con palabras, la reacción era entre el nitrógeno del aire y el carburo de calcio (CaC2), y lo que se obtenía era carbono puro (C) y la molécula que es el objetivo de la reacción, la cianamida de calcio (CaCN2).
El carburo de calcio de la reacción se obtenía a su vez mediante un proceso descubierto unos años antes, por el que el óxido de calcio (CaO), un mineral muy común y barato, producía carburo al combinarlo con carbón de coque a muy alta temperatura:
CaO + 3C → CaC2 + CO
Por lo tanto, los compuestos requeridos para el proceso Frank-Caro eran relativamente comunes. El resultado, la cianamida de calcio (CaCN2), podía emplearse directamente como fertilizante nitrogenado. Sin embargo, resultó ser menos eficaz de lo que se pensaba, y desde luego mucho menos que otros, como los nitratos.
Afortunadamente, aunque la cianamida no fuese muy buen fertilizante, era posible convertirla en otra molécula mucho más versátil, capaz de producir multitud de fertilizantes nitrogenados diferentes: el amoníaco (NH3). La razón es que la cianamida, al reaccionar con agua, produce lo siguiente:
CaCN2 + 3H2O → 2NH3 + CaCO3
De modo que, aunque fuese indirectamente, el proceso de Frank-Caro fue durante un tiempo la salvación de la agricultura intensiva. En pocos años se construyeron muchas fábricas de cianamida, la mayor de todas en Odda, en Noruega, y no en Alemania como podrías pensar en un principio.

Antiguos hornos de producción de cianamida mediante el método Frank-Caro en Odda [David Aasen Sandved/ CC Attribution-Sharealike 3.0 License].
¿Por qué razón en Noruega y no Alemania? Porque los hornos que ves en la foto, en los que se alcanzaba la temperatura necesaria para arrancar la reacción, empleaban grandes resistencias eléctricas. El consumo de electricidad para producir la cianamida era muy grande, más aún teniendo en cuenta que el carburo de calcio obtenido a partir de su óxido que hemos mencionado antes necesita también hornos eléctricos.
Y Noruega disponía –y dispone hoy– de una industria hidroeléctrica descomunal: electricidad relativamente barata para alimentar los hornos de cianamida. Europa estaba tan hambrienta de fertilizantes nitrogenados que la fábrica de Odda y otras más pequeñas produjeron muchos miles de toneladas anuales a principios del siglo XX. Tal vez no fuese el proceso idóneo, pero era mucho mejor que depender del comercio internacional de salitre o guano.
Aunque el proceso de Frank-Caro fuera factible en Noruega, los noruegos intentaron desarrollar otros más eficaces. Un hombre de negocios, Samuel Eyde, había comprado hacia el cambio de siglo varias plantas hidroeléctricas, y estaba buscando un modo de obtener fertilizantes nitrogenados de ese modo; en una cena conoció al físico Kristian Olaf Birkeland, un tipo poco conocido pero realmente genial, y juntos fundaron Norsk Hydro, que sigue existiendo hoy.

Kristian Birkeland (1867-1917) y Samuel Eyde (1866-1940) [dominio público].
El método Birkeland-Eyde era bien diferente del de Frank-Caro. En este caso se realizaba la reacción en un horno que producía un arco eléctrico –una chispa descomunal de enorme temperatura– que, mediante un campo magnético, se hacía incidir sobre un gran disco metálico. Luego se hacía pasar aire sobre el disco, que gracias al arco eléctrico se calentaba hasta unos tres mil grados.
En esas condiciones extremas, el N2 del aire reaccionaba con el O2 para producir monóxido de nitrógeno:
N2 + O2 → 2NO
A su vez, el monóxido de nitrógeno se dejaba enfriar y se combinaba de nuevo con oxígeno atmosférico para producir dióxido de nitrógeno:
NO + O2 → 2NO2
Finalmente el dióxido de nitrógeno se disolvía en agua para producir ácido nítrico, que además de muchas aplicaciones industriales puede emplearse para obtener muchos fertilizantes nitrogenados diferentes:
3NO2 + H2O → HNO3 + NO
Pero el método Birkeland-Eyde seguía necesitando de grandes cantidades de energía. Esto era un problema incluso en Noruega con sus grandes plantas hidroeléctricas, pero mucho más en el resto del mundo, donde no existía esa ventaja. De modo que los científicos siguieron buscando, y uno de ellos encontró la solución – nuestro héroe de hoy, Fritz Haber.
La historia de Haber es bien trágica y llena de brillos y sombras: no es, como ha sucedido otras veces, alguien a quien sea fácil admirar sin reservas. Tiene además giros irónicos, como pasa tantas veces en la historia. No quiero aburrirte con toda su biografía, pero sí dar alguna pincelada que te dé una idea de su carácter.
Haber nació en 1868 en Breslau, en lo que entonces era Prusia y ahora es Polonia, justo antes de la unificación alemana. Era de familia judía –algo que ya sabes si has leído los artículos sobre Max von Laue o Max Planck–, lo cual le supondría grandes problemas más adelante en una de las ironías que mencionaba antes.

Fritz Haber en 1891, con veintidós años y pelo [dominio público].
Tras estudiar en las Universidades de Heidelberg, Berlín y Charlottenburg, y trabajar un par de años en puestos no demasiado interesantes, en 1894 Haber entró a formar parte de la Universidad de Karlsruhe. Tenía por entonces veintiseis años. En Karlsruhe, Haber se especializó en electroquímica, y fue allí donde descubrió un proceso muy superior a los de Frank-Caro y Birkeland-Eyde para fijar nitrógeno.
El camino que intentó Haber era completamente diferente al de los otros, aunque no original: combinar el nitrógeno atmosférico con hidrógeno para formar amoníaco. Seguro que alguna vez has visto esta reacción en el colegio:
N2 + 3H2 → 2NH3
Es algo muy simple. Además, los ingredientes son facilísimos de obtener: ya hemos hablado del nitrógeno atmosférico, pero el hidrógeno también es muy abundante. No existe puro en la atmósfera, pero es posible obtenerlo con relativa facilidad de multitud de reacciones químicas.
De hecho, varios científicos antes de Haber habían intentado producir esta reacción para obtener amoníaco, entre ellos químicos de la talla del francés Henry Louis Le Châtelier, al que puede que conozcas por el principio que lleva su nombre y que, irónicamente, es parte de la causa de que la reacción de arriba no funcione tan bien como debería. A ver si puedo explicarlo razonablemente bien, empezando por el principio de Le Châtelier.
Ese principio dice, mal y pronto, lo siguiente: cuando se alteran las condiciones en las que se produce una reacción química, el equilibrio de la reacción cambia a su vez tratando de compensar la alteración que hemos producido.

Henry Louis Le Châtelier (1850-1936) [dominio público].
Por ejemplo, supongamos que tenemos una reacción en la que los reactivos ocupan muy poco espacio y los productos mucho espacio. Si modificamos las condiciones de la reacción de manera que restringimos el volumen disponible, dado que los productos ocupan más volumen que los reactivos, el equilibrio se desplazará a los reactivos y produciremos menos de lo que obteníamos antes.
Otro ejemplo: si una reacción absorbe energía térmica para producirse –dicho técnicamente, es endotérmica– y aumentamos la temperatura, dado que hay más energía térmica disponible, la reacción se producirá más fácilmente y obtendremos más cantidad de producto.
Como ves, es posible entonces hacer que una reacción produzca mayor o menor cantidad de productos modificando las condiciones. El problema surge cuando no hay manera de conseguirlo fácilmente, como es el caso de la obtención de amoníaco de arriba.
Por un lado, la reacción de obtención de amoníaco a partir de hidrógeno y nitrógeno es exotérmica, es decir, libera energía térmica de manera neta. Esto significa que, de acuerdo con el principio de Le Châtelier, cuanto mayor sea la temperatura menos amoníaco se producirá, y más quedará de nitrógeno e hidrógeno. Por lo tanto lo ideal sería producir la reacción a baja temperatura.
El problema es que cuanto menor es la temperatura, más lenta es cualquier reacción química, y la de arriba es lentísima a temperaturas bajas: tan lenta que es casi imposible darse cuenta de que se esté produciendo. ¿Te das cuenta del dilema? A bajas temperaturas es una reacción lentísima, y a altas temperaturas, debido al principo de Le Châtelier, también lo es… parece no haber solución.
Sin embargo, la hay, como descubrió Haber en Karlsruhe. Es necesario hacer dos cosas para que la obtención de amoníaco funcione.
Por una parte hace falta emplear de nuevo el principio de Le Châtelier, pero no en cuanto a la temperatura, sino en cuanto a la presión. Como he dicho antes, el espacio disponible afecta al equilibrio de las reacciones químicas en las que algo –reactivos o productos– ocupa más que el otro. En el caso de esta reacción:
N2 + 3H2 → 2NH3
Los reactivos ocupan más del doble que los productos. La razón es que, al ser todos ellos gases, y puesto que cada mol de cualquier gas ocupa prácticamente lo mismo que el de otro gas, aquí ganan claramente los de la izquierda: hay un mol de nitrógeno y tres de hidrógeno, es decir, cuatro moles, por cada dos moles de amoníaco.
Esto significa que si comprimimos mucho el recipiente en el que se produce la reacción, la estaremos forzando hacia el lado del amoníaco, que ocupa menos espacio. Al aumentar la presión a niveles tremendos, es posible hacer que la reacción se produzca como deseamos incluso a grandes temperaturas, algo necesario para compensar la lentitud a bajas temperaturas.

Fritz Haber en el laboratorio [dominio público].
El problema de esto no es tanto teórico como práctico: Haber se dio cuenta de que hacían falta presiones de más de doscientas veces la atmosférica para que el equilibrio de la reacción se desplazase lo suficiente hacia la derecha. No había muchas válvulas, tuberías y recipientes que soportasen algo así a principios del siglo XX.
De modo que la cuestión fue más de ingeniería que de ciencia, y Haber consiguió el instrumental necesario para alcanzar esas condiciones extremas de presión, además de unos quinientos grados de temperatura. Y, para producir amoníaco a un ritmo razonable, hacía falta algo más: un catalizador.
Ya hemos hablado sobre catálisis en esta misma serie, ya que Wilhelm Ostwald obtuvo su Nobel de Química en1909 precisamente por eso, de modo que te invito a que leas aquel artículo si quieres recordar en qué consisten los catalizadores. Haber trabajó con varios y determinó que el que mejor aceleraba la velocidad de reacción era el osmio, aunque también era posible emplear hierro.
En 1913 Haber publicó un artículo en el que describía cómo obtener amoníaco a partir de nitrógeno y oxígeno, a enormes presiones y temperaturas no demasiado altas, empleando catalizadores metálicos. El artículo, Über die technische Darstellung von Ammoniak aus Elementen” (“Sobre la producción técnica de amoníaco a partir de sus elementos”), era clarísimo y demoledor en sus resultados.

Equipo con el que Haber realizó su proceso en el laboratorio [dominio público].
Sólo había un pequeño problema: el experimento de Haber era de laboratorio, es decir, a muy pequeña escala. Alemania necesitaba amoníaco barato y en cantidades industriales, de modo que era necesario adaptar el proceso de Haber a escala industrial, y para ello se unió a él un ingeniero químico, Carl Bosch, del que hablaremos más en detalle cuando lleguemos al Nobel de Química de 1931.
El objetivo de Bosch era precisamente ése: tomar el aparato de Haber y transformarlo en una máquina capaz de producir no gramos de amoníaco, sino toneladas. Y Bosch lo consiguió, de modo que hoy en día seguimos llamando al método proceso de Haber-Bosch, aunque la base experimental fuese de Fritz Haber. En poco tiempo el proceso de Haber-Bosch se convirtió en el rey de la producción de amoníaco, y terminó acabando con los de Frank-Caro y Birkeland-Eyde, ya que era muchísimo más eficiente energéticamente.

Carl Bosch (1874-1940) [dominio público].
Y aquí llegamos, desgraciadamente, a la parte oscura de la historia. Alemania estaba muy interesada en el amoníaco y los compuestos nitrogenados derivados de él por dos razones: una eran los fertilizantes. En 1914 estalló la Gran Guerra, y hubiera sido un desastre para Alemania depender de importaciones de nitrato de Chile y cosas parecidas.
Pero los compuestos nitrogenados también tienen otro uso importante, especialmente en guerra: los explosivos. Muchos explosivos son compuestos de este tipo: seguro que conoces la nitroglicerina, cuyo nombre no es ése por casualidad. El proceso de Haber-Bosch se empleó para producir ingentes cantidades de explosivos para combatir en la Gran Guerra, y supuso una bocanada de aire fresco para Alemania no sólo en agricultura sino en el arte de matar.
La oscuridad no termina ahí. Fritz Haber fue uno de los químicos alemanes más importantes en el desarrollo de armas químicas en la Gran Guerra. Ya hemos hablado de armas químicas en el pasado, y la Primera Guerra Mundial fue el momento en el que este horror se reveló al mundo en todo su espantoso esplendor. Haber puso su talento –que era mucho, sobre todo experimentalmente– al servicio de Alemania, y ya mencioné que intentó reclutar a su amigo Richard Willstätter, aunque el otro se negó.

Ataque químico en la Gran Guerra [dominio público].
Haber actuó en la Gran Guerra con total convicción: se dedicó en cuerpo y alma a la guerra química ofensiva y defensiva. Desarrolló tanto protecciones contra los gases enemigos como gases propios, sobre todo de cloro, y no se limitó a trabajar en el laboratorio, sino que estuvo en el frente de forma activa. En esos momentos es en los que los científicos deben decidir –Willstätter decidió no ayudarlo, por ejemplo–, y Haber decidió sin dudar.
Su mujer, por el contrario, se opuso fervientemente a esta decisión. Haber se había casado en 1901 con otra química, Clara Immerwahr, a quien la participación de su marido en la carrera armamentística química le parecía un horror. Ambos discutieron acaloradamente sobre ello varias veces, pero Haber se mantuvo absolutamente rígido: su patria lo necesitaba y no iba a andarse con zarandajas, y alguien muerto por un rifle no está menos muerto que alguien muerto por gases tóxicos.

Clara Immerwahr (1870-1915) [dominio público].
En 1915 Haber regresó a casa tras supervisar el uso de armas químicas en la Segunda Batalla de Ypres, y el matrimonio tuvo una fortísima discusión. Al terminar, Clara salió al jardín y se suicidó con el revólver de servicio de Fritz. Como verás, no decía que la historia era trágica por decir – realmente es terrible. A la mañana siguiente Haber partió de nuevo hacia el frente oriental, ya que Alemania también iba a emplear armas químicas contra los rusos. En sus propias palabras,
En tiempos de paz un científico pertenece al mundo, pero en tiempos de guerra pertenece a su país.

Fritz Haber en el frente en 1917 [dominio público].
Su país, sin embargo, no sería muy agradecido con él, al menos no a largo plazo. Al principio sí, ya que el propio Kaiser lo nombró capitán y recibió condecoraciones varias, pero todo cambiaría en unos años. En 1919 Haber ganó el Nobel gracias al desarrollo del proceso que acabamos de mencionar, lo cual lo hizo aún más famoso y popular en Alemania, pero todo iba a cambiar y seguro que sabes por qué.
Como he dicho al principio, la familia de Haber era judía. Él se convirtió al luteranismo durante su vida, pero para los Nazis era judío de cabo a rabo, por muy patriota y talentoso que fuera.
Ya hemos hablado antes en la serie de la Berufsbeamtengesetz, la Ley para la Restauración del Servicio Civil Profesional que eliminaba del servicio público a los judíos como Haber; en su momento les pareció terrible, porque no sabían lo que vendría después, supongo. El caso es que un día de 1933, cuando Haber se dirigía a su trabajo en el Instituto del Kaiser Guillermo en Berlín, el portero le impidió el paso: “El judío Haber no puede entrar aquí”, le dijo.
La vida es a veces irónica: el patriota Haber recibía su recompensa. Aunque fuese tan sólo un gesto, dimitió de su puesto como protesta. Poco después se exilió, y murió en Suiza un año más tarde, olvidado por casi todos – aunque no por todos, como sabes por el artículo de von Laue.

Fritz Haber junto a Albert Einstein en 1915 [dominio público].
No quiero terminar de este modo tan siniestro, de modo que permite que te recuerde algo que tal vez te reconcilie con Fritz. El proceso de Haber-Bosch, aunque suene a algo anodino, sigue empleándose hoy en día para producir una cantidad ingente de amoníaco destinado sobre todo a los fertilizantes nitrogenados, sin los que miles de millones de personas morirían de hambre.
¡No exagero! Para que te hagas una idea, entre el 1 y el 2% de toda la energía eléctrica producida en el mundo cada año se destina al proceso de Haber-Bosch. La población mundial en 1900 era de mil quinientos millones de personas, y hoy en día es de más de siete mil millones – algo imposible sin el amoníaco de Haber.
Una última estadística que me hace abrir la boca. De cada cuatro átomos de nitrógeno de tu cuerpo, querido y pacientísimo lector, tres átomos proceden del proceso de Bosch-Haber a través de la comida –verduras fertilizadas o animales que han comido verduras fertilizadas con él–. Nuestra sociedad, para bien o para mál, está construida entre otras cosas sobre esa reacción del colegio:
N2 + 3H2 → 2NH3
Sin más, te dejo con las palabras pronunciadas el 1 de junio de 1920 por el Doctor Ekstrand, Presidente de la Real Academia Sueca de las Ciencias:
Damas y caballeros.
La Real Academia Sueca de las Ciencias ha decidido otorgar el Premio Nobel de Química de 1918 al Director del Instituto del Kaiser Guillermo en Dahlem, cerca de Berlín: el Profesor Dr. Fritz Haber, por su método para sintetizar amoníaco a partir de sus elementos, el nitrógeno y el hidrógeno.
De acuerdo con el plan económico de la Naturaleza, la fertilidad del suelo se mantiene en condiciones normales a un nivel constante si los productos de desecho de las cosechas se devuelven al suelo; sin embargo, si se requiere una productividad sustancialmente mayor del suelo, es necesario emplear fertilizante adicional. Dado que, al mismo tiempo, una gran proporción de las cosechas anuales es consumida por la población cada vez mayor de las ciudades, y dado que los desechos de las ciudades se devuelven al suelo cultivado sólo en una medida muy baja, la consecuencia inevitable es que el suelo queda exhausto y el rendimiento de las cosechas disminuye. Esto ha llevado, a su vez, a la producción de fertilizantes artificialces, que también ha aumentado año tras año en importancia, hasta tal punto que, al menos en Europa, no existe ningún país que pueda subsistir completamente sin ellos.
De entre estas sustancias, los compuestos nitrogenados ocupan un lugar importante, ya que normalmente el suelo no posee una gran cantidad de ellos para ser liberados en la proporción requerida por las plantas simplemente a causa de la acción atmosférica, como sucede en el caso del ácido fosfórico y la potasa; además, parte del nitrógeno eficaz se convierte en nitrógeno inactivo, el atmosférico, durante este proceso cíclico. Es cierto que parte de esta pérdida se compensa por la lluvia y la acción bacteriana, pero hasta el momento la experiencia nos ha demostrado que no es posible mantener cultivos intensivos sin fertilizantes nitrogenados artificiales. Esto es cierto, por encima de todo, para uno de los cultivos más importantes de la actualidad, la remolacha azucarera.
Durante muchos años sólo existieron dos compuestos nitrogenados artificiales, el nitrato potásico y el cloruro amónico. Los antiguos métodos mediante los que se obtenían, sin embargo, dejaron de tener importancia, al menos en Europa y América, cuando el salitre de Chile (nitrato sódico) hizo su aparición, y cuando se empezó a hacer uso de los productos de desecho de la destilación en seco del carbón mineral para este propósito.
El consumo de salitre de Chile, calculado en términos de nitrógeno, es de unas 500 000 o más toneladas anuales. En condiciones normales, la inmensa mayoría de este salitre se emplea como fertilizante. Por lo tanto, la pregunta esencial durante mucho tiempo ha sido ¿cuánto tiempo durarán los depósitos de salitre de Chile? Las autoridades chilenas dan estimaciones muy vagas, y los expertos europeos son de la opinión de que, al ritmo de producción actual, los depósitos se agotarán en un futuro relativamente cercano.
Sea como fuere, la larga Guerra Mundial ha demostrado fehacientemente a todos los países la necesidad de organizar, lo antes posible, la producción de materias primas esenciales dentro de sus propias fronteras y en la suficiente cantidad como para cubrir sus necesidades.
Ahora bien, dado que el salitre [sigue refiriéndose al nitrato de sodio] es la más importante de estas sustancias, especialmente en aquellos países que no disponen de grandes depósitos de carbón mineral ni energía hidroeléctrica barata, la producción artificial de amoníaco y ácido nítrico ha alcanzado un grado de importancia inaudito.
El amoníaco obtenido por la destilación en seco del carbón bituminoso y marrón es una sustancia en el límite entre los productos naturales y artificiales. Este amoníaco proviene del nitrógeno contenido en estos minerales, en un 1,3% en peso, del que sin embargo la mayor parte (alrededor del 85%) permanece en el coque o se libera como nitrógeno durante la destilación.
Durante los primeros diez años de este siglo se publicaron varios métodos, basados en atrapar el nitrógeno del aire, pero muy pocos sobrevivieron la etapa de prueba. El primero de ellos fue el método de la cianamida de Frank-Caro. La cianamida de calcio [¿se dice así, o cianamiduro de calcio? ¿químicos?] no fue un fertilizante tan eficaz como se pensaba, pero dado que su contenido en nitrógeno puede convertirse relativamente en amoníaco, esto no ha resultado ser un obstáculo para emplear este método cada vez en mayor medida.
Es posible calcular, utilizando los principios fundamentales de la Termodinámica, todas las condiciones cuantitativas respecto a la combustión de nitrógeno atmosférico para producir óxido nítrico. Birkeland y Eyde fueron, por supuesto, los primeros en emplear esto técnicamente con resultados satisfactorios.
Hasta 1904 nadie había sido capaz de producir una combinación directa de nitrógeno e hidrógeno para formar amoníaco sin la ayuda de una descarga eléctrica, aunque los experimentos de Berthelot y Thomson demostraron que la combinación era exotérmica. Con la experiencia que tenemos ahora podemos ver fácilmente que este resultado negativo se debía a la lentitud de la reacción a bajas temperaturas, y las condiciones de equilibrio desfavorables a altas temperaturas. Es cierto que en 1884 Ramsay y Young habían realizado algunos experimentos sobre esto, utilizando limaduras de hierro como catalizador, pero estos experimentos sólo produjeron resultados inciertos.
En 1904 Haber y van Oordt comenzaron un estudio metódico de este importante campo, basándose en métodos físico-químicos modernos, después de que un único experimento anterior diese a Haber la esperanza de encontrar una solución técnica al problema. Trabajaron a una temperatura de unos 1 000 °C y a presión normal, utilizando hierro como catalizador. De estos experimentos se dedujo que en calor rojo o a mayor temperatura, y también a mayor presión, sólo se formaban trazas de amoníaco.
Durante este período también se demostró experimentalmente por primera vez que existe un estado de equilibrio real en el sistema N2 + 3H2 ↔ 2NH3, que constituye de hecho la base real para la síntesis del amoníaco.
Es posible encontrar en el “Zeitschrift für Elektrochemie” de 1913 el tratamiento de esta cuestión por Haber y Le Rossignol que tiene el mayor significado práctico: “Über die technische Darstellung von Ammoniak aus Elementen” (“Sobre la producción técnica de amoníaco a partir de sus elementos”). Este tratado supuso la fundación del desarrollo del método a escala industrial en la “Badische Anilin- und Sodafabrik” de Ludwigshafen, donde el máximo desarrollo se produjo bajo la dirección del Dr. C. Bosch.
Los experimentos anteriores habían demostrado la inutilidad de exceder la temperatura del rojo oscuro, es decir, unos 600 °C. Por otro lado, la fórmula de la reacción demostraba que la combinación se produce con una contracción de 4 volúmenes a 2. Se deduce de la ley de equilibrio que a mayor presión el equilibrio debe desplazarse hacia el lado del amoníaco. Esto proporcionó el principio básico.
Era necesario emplear una temperatura de unos 500 °C a la máxima presión posible, lo cual era en la práctica de unas 150-200 atmósferas. También podía suponerse que esta alta presión aceleraría la reacción. Sin embargo, trabajar con el flujo de un gas en circulación a tan alta presión y temperatura suponía grandes dificultades, y no había sido intentado antes.
Sin embargo, tuvo un éxito total. El artículo en cuestión contiene diagramas detallados del equipo empleado con el que, utilizando hierro como catalizador, se produjeron unos 250 gramos de amoníaco por hora y litro de volumen en contacto; empleando uranio u osmio como catalizadores se produjo considerablemente más.
El calentamiento se realiza eléctricamente. Sin embargo, dado que el calor que escapa del aparato se compensa en gran parte con los gases que entran, es posible mantener la temperatura necesaria mediante este calor regenerado y el liberado en la formación del amoníaco. Un punto muy importante en las observaciones de Haber es que es posible dar a los gases un flujo más rápido durante la reacción, lo cual por supuesto aumenta sustancialmente la cantidad de amoníaco producida por unidad de tiempo.
Haber determinó que el mejor catalizador era el osmio, seguido de uranio o carburo de uranio. De acuerdo con las pruebas realizadas sobre todo en las fábricas de la “Badische”, la actividad del catalizador podía aumentarse mediante ciertos óxidos o sales de metales alcalinos y alcalino-térreos, lo mismo que era posible disminuirse mediante venenos catalíticos [catalizadores negativos, supongo]. Se han ido descubriendo gradualmente catalizadores más activos, y mediante ello ha sido posible reducir sustancialmente la presión en la cámara.
En 1910 se comenzó la construcción de la primera fábrica a gran escala cerca de Oppau, en las proximidades de Frankfurt am Main, con una producción anual estimada de unas 30 000 toneladas de amoníaco. Los materiales básicos, nitrógeno y oxígeno, se producen mediante métodos estándar.
El consumo energético en el proceso de obtención de amoníaco es muy bajo, no más de 0,5 kilovatios-hora por cada kilo de amoníaco. Es posible fijar, por tanto, no menos de 10 000 kilogramos de nitrógeno por cada kilovatio-año.
Dado que la posición de equilibrio de la reacción depende, entre otras cosas, del calor de formación del amoníaco y su calor específico, en una serie de siete artículos en el “Zeitschrift für Elektrochemie” de 1914-1915 Haber ha descrito experimentos llevados a cabo para confirmar estas cifras con la máxima precisión posible.
Dado que, de acuerdo con el método modificado de Ostwald, es posible convertir el amoníaco en ácido nítrico y éste en nitrato de calcio, la proporción de los costes totales de producción del nitrato de calcio es, de acuerdo con los cálculos disponibles, aproximadamente la siguiente: Norsk Hydro: 100 Haber: 103 Frank-Caro: 117
En otras palabras, son iguales para los dos primeros métodos, pero aproximadamente un 15% más altos para el tercero.
Sin embargo, dado que de los tres métodos de fijar nitrógeno el de Haber es el único capaz de funcionar sin necesidad de una fuente barata de energía hidroeléctrica, podrá emplearse en el futuro en todos los países; puesto que, además, puede utilizarse a cualquier escala conveniente, y ya que puede producir amoníaco de un modo mucho más barato, y nitrato al mismo precio que cualquier otro método, como se ha dicho antes, es de una importancia universal para la mejora de la nutrición humana y, por lo tanto, de gran beneficio para la humanidad.
Las fábricas alemanas de Haber, especialmente la recientemente construida Leuna Works cerca de Merseburgo, también están a plena producción, proporcionando la mayor parte de todos los fertilizantes nitrogenados de Alemania. Además, el método ya ha sido empleado a gran escala en los Estados Unidos de América.
Profesor Haber. La Academia de las Ciencias de este país le ha otorgado el Premio Nobel de Química de 1918 en reconocimiento a sus grandes servicios a la solución del problema de combinar directamente nitrógeno atmosférico con hidrógeno. Se han intentado encontrar soluciones a este problema de manera repetida en el pasado, pero usted ha sido el primero en obtener una solución industrial, y por lo tanto ha creado un medio importantísimo de mejorar los estándares de la agricultura y el bienestar de la humanidad.
Lo felicitamos por este triunfo en servicio de su país y toda la humanidad. Por favor, acepte ahora su premio de manos del Presidente de la Fundación Nobel.
En la siguiente entrega, el Nobel de Física de 1919, entregado a Johannes Stark.
Para saber más (esp/ing cuando es posible):